Anvisa suspende medicamento milionário para distrofia muscular após mortes nos EUA
Decisão ocorre após a agência reguladora dos EUA relatar três mortes por insuficiência hepática aguda; remédio é um dos mais caros do mundo
Wagner Lauria Jr.
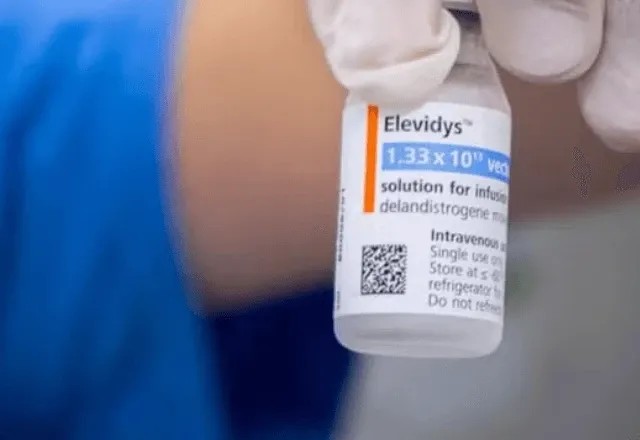
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou a suspensão temporária do medicamento de terapia gênica Elevidys (delandistrogeno moxeparvoveque), indicado para um tipo raro de distrofia muscular. A medida vale para fabricação, comercialização, distribuição, importação, propaganda e uso do produto no Brasil.
A decisão, publicação em edição extra no Diário Oficial da União desta quinta-feira (24), ocorre após a agência reguladora dos Estados Unidos, a FDA, relatar três mortes por insuficiência hepática aguda em pacientes que receberam medicamentos com a mesma tecnologia do Elevidys.
Dois dos casos ocorreram em adolescentes com Distrofia Muscular de Duchenne (DMD) tratadas com o próprio Elevidys; o terceiro foi em um adulto com outra forma da doença, utilizando um produto experimental.
Apesar de nenhum dos casos fatais ter acontecido no Brasil e de envolverem pacientes fora da faixa autorizada pela Anvisa, a agência optou por agir preventivamente. A suspensão vale até que os riscos sejam totalmente esclarecidos.
Inicialmente, em junho deste ano, mesmo após suspensão do medicamento nos EUA, a Anvisa optou por não estender a decisão para o Brasil, uma vez que o público afetado já não era elegível para a terapia no país.
Em nota na ocasião, a Agência afirmou que acompanha o caso e mantém monitoramento contínuo.
Procurada, a Roche disse que "iniciou uma pausa voluntária temporária em todos os novos pedidos de Elevidys® para pacientes com Distrofia Muscular de Duchenne (DMD), com efeito a partir de 24 de julho de 2025, em consonância com o movimento em outros países, como uma medida de precaução" e ressaltou que nenhum dos casos fatais possui indicação para terapia no Brasil.
"A Roche está comprometida em buscar, com senso de urgência, os esclarecimentos necessários para que o fornecimento do medicamento possa ser retomado. Manteremos um diálogo transparente e contínuo com as agências regulatórias, comunidade médica e as organizações de pacientes para endereçar todas as questões, rearmando nosso compromisso inabalável com a segurança e a saúde dos pacientes", finaliza a nota.
Uso restrito no Brasil
O Elevidys foi autorizado no Brasil em dezembro de 2024, em caráter excepcional, apenas para crianças de 4 a 7 anos que andam e têm mutação confirmada no gene causador da DMD. A empresa responsável pela comercialização no país é a Roche Farma Brasil.
A autorização previa monitoramento intensivo dos pacientes e confirmação da eficácia a longo prazo. Até agora, cerca de 10 crianças brasileiras foram tratadas com o medicamento. Segundo a Anvisa, não há registro de efeitos graves ou inesperados nessa população no país.
Casos registrados no Brasil
A Roche notificou três eventos adversos relacionados ao uso do Elevidys® no Brasil. Dois deles foram classificados como prováveis, mas com evolução positiva. Os sintomas observados, como aumento de enzimas musculares e problemas gastrointestinais, já constam na bula e estão dentro do esperado para esse tipo de terapia.
O terceiro caso, que resultou em óbito, foi relacionado a uma infecção viral grave (gripe Influenza A) e não teve ligação direta com o medicamento, segundo análise da Anvisa.
A própria bula do Elevidys® recomenda adiar o tratamento em casos de infecções ativas e orienta a vacinação dos pacientes, uma vez que o uso de corticoides pode diminuir a imunidade.
Risco hepático em investigação
O Elevidys utiliza uma tecnologia chamada vetor AAVrh74, que serve para levar o gene corrigido às células musculares do paciente. No entanto, esse vetor também tem afinidade pelo fígado, o que pode causar hepatite e aumento de enzimas hepáticas, principalmente se houver resposta imunológica ao tratamento.
Esse tipo de risco já era conhecido e está descrito na bula do produto. No entanto, diante das mortes registradas nos Estados Unidos, a Anvisa decidiu reavaliar a segurança da terapia no Brasil, em alinhamento com decisões semelhantes de outros países.
Como funciona o Elevidys?
Trata-se de um tratamento de dose única, administrado por via intravenosa, que utiliza um vetor viral para levar ao organismo um gene modificado que instrui o corpo a produzir a microdistrofina, uma versão funcional e reduzida da proteína distrofina.
O objetivo é restaurar parcialmente a função muscular, principalmente em pacientes na fase inicial da doença. A eficácia a longo prazo ainda está sendo avaliada em estudos clínicos, especialmente nos grupos mais debilitados.
O remédio também chama atenção pelo custo: é um dos medicamentos mais caros do mundo. Nos Estados Unidos, custa cerca de US$ 3,2 milhões. No Brasil, seu preço foi fixado pela Câmara de Regulação do Mercado de Medicamentos (CMED) em até R$ 20 milhões por dose – o mais alto já aprovado no país.